Ăn Mòn Kim Loại Là Gì
I – KHÁI NIỆM
Sự bào mòn sắt kẽm kim loại là sự việc phá huỷ kim loại hoặc kim loại tổng hợp bởi tác dụng của các chất vào môi trường thiên nhiên bao bọc.
Bạn đang xem: ăn mòn kim loại là gì
M → Mn+ + ne
II – CÁC DẠNG ĂN MÒN KIM LOẠI
Có 2 dạng làm mòn sắt kẽm kim loại là ăn mòn chất hóa học và bào mòn năng lượng điện hóa học
1. Ăn mòn hoá học
VD – Tkhô cứng sắt vào xí nghiệp sản xuất chế tạo khí Cl2
sắt + Cl2 → FeCl3
⇒ Ăn mòn hoá học tập là quá trình oxi hoá – khử, trong số ấy những electron của sắt kẽm kim loại được đưa trực tiếp nối những chất trong môi trường xung quanh.
2. Ăn mòn năng lượng điện hoá học
a. Khái niệm về bào mòn điện hóa
Hiện tượng:– Kyên điện kế quay ⇒ chứng minh có dòng điện chạy qua.
– Tkhô cứng Zn bị mòn dần dần.
– Bọt khí H2 thoát ra cả ở tkhô cứng Cu.
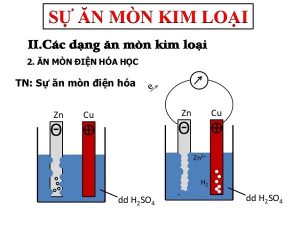
– Điện cực âm (anot); Zn bị ăn mòn theo phản bội ứng: Zn → Zn2+ + 2e
Ion Zn2+ lấn sân vào hỗn hợp, các electron theo dây dẫn thanh lịch năng lượng điện rất Cu.
– Điện cực dương (catot): ion H+ của dung dịch H2SO4 dìm electron trở thành ngulặng tử H rồi thành phân tử H2 bay ra.: 2H+ + 2e → H2↑
⇒ Ăn mòn năng lượng điện hoá là quá trình oxi hoá – khử, trong các số đó sắt kẽm kim loại bị làm mòn vị tính năng của hỗn hợp chất năng lượng điện li cùng làm cho loại electron vận động và di chuyển trường đoản cú cực âm đến rất dương.
b. Ăn mòn năng lượng điện hoá học hợp kim Fe vào bầu không khí ẩm
VD: Sự ăn mòn gang vào không khí ẩm.
Xem thêm: Temple Run 2 1 - Temple Run 2 On The App Store
– Trong không khí độ ẩm, bên trên mặt phẳng của gang luôn luôn tất cả một nước vô cùng mỏng dính đã hoà tan O2 với khí CO2 , sản xuất thành hỗn hợp chất điện li.
– Gang tất cả yếu tố đó là Fe và C cùng xúc tiếp cùng với dung dịch kia tạo cho vô số những pin nhỏ dại cơ mà Fe là anot và cacbon là catot.
Tại anot: Fe → Fe2+ + 2e
Các electron được giải pđợi di chuyển mang lại catot.
Tại catot: O2 + 2H2O + 4e → 4OH–
Ion Fe2+ rã vào hỗn hợp chất điện li có hoà chảy khí O2.Tại phía trên, ion Fe2+ liên tục bị oxi hoá, dưới chức năng của ion OH− tạo thành gỉ Fe bao gồm yếu tố chủ yếu là Fe2O3.nH2O.
c. Điều kiện xẩy ra sự ăm mòn năng lượng điện hoá học
Các năng lượng điện cực đề xuất khác biệt về bản chất.Cặp KL – KL; KL – PK; KL – Hợp chất hoá học
Các năng lượng điện rất bắt buộc tiếp xúc trực tiếp hoặc loại gián tiếp qua dây dẫn.Các điện cực thuộc xúc tiếp với một hỗn hợp chất điện li.III, Các phương thức chống làm mòn klặng loại
1, Pmùi hương pháp bảo đảm bề mặt: sơn; mạ kim loại
2, Pmùi hương pháp điện hóa
3, Sản xuất vật tư không xẩy ra nạp năng lượng mòn: kim loại tổng hợp không trở nên ăn mòn
Bài tập pin điện hóa gồm lời giải
Bài 1: Tính thế điện cực chuẩn E0 của những cặp oxi hóa khử sau:
a. E0 (Cr3+/Cr), biết suất điện động chuẩn của pin điện hóa Cr -Ni là +0,51V và E0 (Ni2+/Ni) = -0,23V.
Xem thêm: Cách Dùng Đại Từ Sở Hữu Là Gì, Đại Từ Sở Hữu (Possessive Pronoun)
b. E0 (Mn2+/Mn), biết suất điện động chuẩn của pin điện hóa Cd -Mn là +0,79V và E0(Cd2+/Cd) = -0,40V.